Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
 -lactamaseによるCs
-lactamaseによるCs 及びSr
及びSr 認識機構
認識機構新井 栄揮; 米澤 悌; 安達 基泰; 徳永 廣子*; 石橋 松二郎*; 徳永 正雄*; 黒木 良太
no journal, ,
蛋白質は金属イオンの電荷数の違いやイオン半径のわずかな違い(Na
 1.14
1.14 , K
, K
 1.52
1.52 , Mg
, Mg
 0.86
0.86 , Ca
, Ca
 1.14
1.14 )などを識別することができる。これまでにわれわれは蛋白質が有する上記の特徴に着目し、蛋白質を利用した希少金属の捕集研究を進めてきたが、原子力発電所事故を背景に、Cs, Sr捕集蛋白質材料の開発に着手した。その一環としてわれわれは、分子表面に数多くの負電荷を有し、多くの金属イオンを結合できる可能性がある
)などを識別することができる。これまでにわれわれは蛋白質が有する上記の特徴に着目し、蛋白質を利用した希少金属の捕集研究を進めてきたが、原子力発電所事故を背景に、Cs, Sr捕集蛋白質材料の開発に着手した。その一環としてわれわれは、分子表面に数多くの負電荷を有し、多くの金属イオンを結合できる可能性がある sp.560由来・好塩性
sp.560由来・好塩性 -Lactamase(HaBLA)について、X線結晶解析によるCs
-Lactamase(HaBLA)について、X線結晶解析によるCs , Sr
, Sr 結合部位の抽出を試みた。0.1M Cs
結合部位の抽出を試みた。0.1M Cs , 0.2M Sr
, 0.2M Sr を含む結晶化溶液から得られたHaBLA結晶について、空間群
を含む結晶化溶液から得られたHaBLA結晶について、空間群 3
3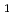 ,分解能2.0
,分解能2.0 ,格子定数a=b=115.9
,格子定数a=b=115.9 , c=67.9
, c=67.9 , Rmerge 9.6%の回折データを取得し、非対称単位(蛋白質3分子)あたり3つのCs
, Rmerge 9.6%の回折データを取得し、非対称単位(蛋白質3分子)あたり3つのCs 結合部位、及び、6つのSr
結合部位、及び、6つのSr 結合部位の同定に成功した。Cs
結合部位の同定に成功した。Cs , Sr
, Sr 選択性の高い金属結合部位を抽出できれば、その構造をスカフォールドとしてCs
選択性の高い金属結合部位を抽出できれば、その構造をスカフォールドとしてCs , Sr
, Sr 結合部位の人工創製が可能になると期待できる。
結合部位の人工創製が可能になると期待できる。
安達 基泰; 新井 栄揮; 松本 富美子; 黒木 良太; 畠中 孝彰*; 伊東 祐二*; 日高 興士*; 津田 裕子*; 木曽 良明*
no journal, ,
HIV-1プロテアーゼ(HIVPR)はエイズ治療における創薬標的タンパク質である。HIVPRの阻害剤との相互作用解析を目的に、野生型HIVPR及びA17型薬剤耐性HIVPR(A17-HIVPR)に人工的に架橋構造を取らせた誘導体を創製し、阻害剤親和性の比較を行うことにした。われわれはまずHIVPRがC2対称であることに着目し、2回軸付近でかつ基質結合部位の反対側に位置するAsn98をCys98残基に置換することで、SS結合形成型の一本鎖化N98C/HIVPR及びN98C/A17-HIVPRの作製を試みた。N98C/HIVPR及びN98C/A17-HIVPRを、野生型と同様に大腸菌内に封入体として発現させた。既報の方法に従ってリフォールディングした結果、SS結合形成型の収率は、野生型と同程度であった。N98C/HIVPR及びN98C/A17-HIVPR両試料の阻害剤複合体の結晶構造と物理化学的手法による阻害剤相互作用についても報告する。
清水 瑠美; 安達 基泰; 黒木 良太; 山下 未知*; 森元 聡*
no journal, ,
モルヒネの酸化反応を触媒し、細胞壁強化に寄与するモルヒネパーオキシダーゼ-2(MP2)は、極めて高い基質特異性を有するため、構造生物学的観点から興味深い酵素である。そこで、MP2の構造機能相関を明らかにするために、大腸菌発現による組換え型MP2の調製に取り組んでいる。MP2のシグナル配列部分を除去した遺伝子を大腸菌で発現させたところ、組換え型MP2が不溶性タンパク質として大量発現した。変性剤で可溶化後に、還元と酸化条件下におけるSDS-PAGEでの移動度の差を指標に再生条件を検討した。再生処理後、組換え型MP2を陰イオンカラムクロマトグラフィー等で精製し、活性測定を行った結果、生成物であるビスモルヒネの生産が確認され、比活性は天然型と同等であった。また、精製品をHPLCで分析したところ、単一のピークが得られた。以上の結果は、再生した組換え型MP2が天然の酵素と同様に立体構造を形成していることを示唆している。
有森 貴夫; 川本 乃理子*; 岡崎 伸生; 中澤 昌美*; 宮武 和孝*; 上田 光宏*; 玉田 太郎
no journal, ,
好熱性細菌由来キチナーゼ(Ra-ChiC)は、天然資源であるキチンをさまざまな分野で利用できるオリゴ糖へと分解する。しかしRa-ChiCはこれまでに同定されているキチナーゼとはアミノ酸配列の相同性を有さず、キチナーゼとしては唯一GH family 23に分類される。一方、GH family 23にはおもにガチョウ型(G-type)リゾチームが属しているが、Ra-ChiCはリゾチーム活性を有さない。われわれは、Ra-ChiCの基質認識機構及び触媒反応機構を解明するため、触媒ドメインのリガンド非結合型及びキチンオリゴ2糖結合型の結晶構造解析を行った。Ra-ChiCの活性部位の構造から、われわれはRa-ChiCの触媒反応にはG-typeリゾチームにも保存されているE141だけでなく、G-typeリゾチームには保存されていないD226も寄与すると予想した。そこで変異体実験を実施した結果、どちらの残基においても変異体では著しい活性の低下が見られた。さらに、E141Q変異体とキチンオリゴ4糖との複合体についても結晶構造を決定した。この構造をもとにリゾチームの基質の構成要素であるN-アセチルムラミン酸(NAM)の結合モデルを作成したところ、Ra-ChiCではD226が存在するループ領域が活性部位を覆っているため、G-typeリゾチームより基質結合部位が狭く、かさ高い置換基を持つNAMの結合においては立体障害が生じることがわかった。このことから、Ra-ChiCがリゾチーム活性を示さないのは、このような基質結合部位の構造の違いが原因であると考えられた。
松本 富美子; 畠中 孝彰*; 安達 基泰; 清水 瑠美; 玉田 太郎; 伊東 祐二*; 黒木 良太
no journal, ,
トロンボポエチン(TPO)は、血液細胞の一つである巨核球を増殖させるとともに血小板への分化を刺激するサイトカインである。TPO受容体細胞外領域(ecTPOR)にはサイトカイン受容体相同性領域(CRH)が2つ並ぶユニークな配列が存在するが、ecTPOR中のシステイン残基は15箇所と多く、また試料調製中に非特異的なジスルフィド結合を形成して失活しやすいためecTPORの高純度試料の調製はこれまで困難であった。そこでわれわれはecTPORのシステイン残基を選択的に変異させることにより、非特異的なジスルフィド結合形成を抑制した2つのCRH領域(CRH-1とCRH-2)の大腸菌発現系を構築し、第11回日本蛋白質科学会年会にて発表した。さらにわれわれは、ecTPORとTPOとの相互作用を解析するとともに、中和抗体、アゴニスト抗体との相互作用部位を定量的に解析した。表面プラズモン共鳴法により親和性を調べところ、TPOはCRH1とCRH2の両方に結合すること、また既に取得している中和抗体はCRH2に、アゴニスト抗体はCRH1とCRH2の両方に結合することがわかった。先に動物細胞で発現させたecTPORにはTPO結合部位が一箇所だけ存在することを明らかにしていることから、リガンドがCRH1とCRH2の間に結合した際、受容体が活性化し、抗体などによりこの結合が阻害された場合、活性化が抑制されることが示唆された。
 還元酵素反応中間体のX線結晶構造解析
還元酵素反応中間体のX線結晶構造解析山田 貢; 玉田 太郎; 松本 富美子; 竹田 一旗*; 木村 成伸*; 黒木 良太; 三木 邦夫*
no journal, ,
シトクロム 還元酵素(以下
還元酵素(以下 R)は2ドメインからなり、ドメイン間に1個のFADを含み、NADHから電子を2つ受け取りシトクロム
R)は2ドメインからなり、ドメイン間に1個のFADを含み、NADHから電子を2つ受け取りシトクロム に伝達する酸化還元酵素である。本研究は還元型
に伝達する酸化還元酵素である。本研究は還元型 Rの結晶解析及び還元型
Rの結晶解析及び還元型 Rから再酸化型
Rから再酸化型 Rへの時分割結晶解析によって
Rへの時分割結晶解析によって Rの酸化還元サイクルの詳細を解明することを目的とした。還元型
Rの酸化還元サイクルの詳細を解明することを目的とした。還元型 Rの構造において、2つのドメインの相対位置が大きく変化していた。FADのイソアロキサジン環部位は折れ曲がらずに平面構造をとっておりNAD
Rの構造において、2つのドメインの相対位置が大きく変化していた。FADのイソアロキサジン環部位は折れ曲がらずに平面構造をとっておりNAD とスタッキングしていたが、N10窒素は
とスタッキングしていたが、N10窒素は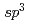 型の幾何配置をとっていた。また、時分割解析の結果、
型の幾何配置をとっていた。また、時分割解析の結果、 Rはニコチンアミド部位を押し出す動きと、ADPリボース部位を押し出す動きの2つの動きによってNAD
Rはニコチンアミド部位を押し出す動きと、ADPリボース部位を押し出す動きの2つの動きによってNAD を放出していことが明らかになった。上記の結果から、
を放出していことが明らかになった。上記の結果から、 Rは(1)ドメインの相対位置変化によってシトクロム
Rは(1)ドメインの相対位置変化によってシトクロム 相互作用部位を作り出す機構、(2)FADH
相互作用部位を作り出す機構、(2)FADH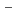 とNAD
とNAD の電荷移動相互作用によって共鳴構造が壊れたFADH
の電荷移動相互作用によって共鳴構造が壊れたFADH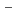 が安定化する機構、(3)電荷移動相互作用の消失に伴いニコチンアミド部位を活性中心から放出した後、ADPリボース部位を放出する機構の存在が示唆された。
が安定化する機構、(3)電荷移動相互作用の消失に伴いニコチンアミド部位を活性中心から放出した後、ADPリボース部位を放出する機構の存在が示唆された。
栗原 和男; 玉田 太郎; 山田 貢; 大原 高志*; 黒木 良太
no journal, ,
膜タンパク質やタンパク質複合体などの立体構造解析に基づくタンパク質間相互作用の解明は、現代の生命科学研究における重要な領域であり、中性子解析から得られる水素原子や水和水の情報を含む立体構造は、タンパク質の機能解明や高機能化に大きく寄与するが、ここで対象となるタンパク質は高分子量であるため、試料結晶の単位格子体積も大きくなり、従来の中性子回折装置では対応できていなかった。そこで、われわれは学術・産業界に広く利用可能な装置として、J-PARC(大強度陽子加速器施設)に大型の単位格子を持つ結晶を測定可能にするタンパク質専用の中性子回折装置の建設を提案し、2つの目標を掲げる。第一に、格子長が250Aを超えるタンパク質結晶の測定を可能にする。第二に、中性子線源の弱さを補うため、高い測定効率を実現する。第1の目標には、反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。第二の目標のため、大型楕円中性子スーパーミラー集光系を採用する。さらに、ビームラインを分割し小型格子用の装置(格子長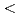 120
120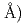 を設置する。以上を実現するために必要な大面積検出器(500mm
を設置する。以上を実現するために必要な大面積検出器(500mm 500mm)と楕円集光系については、J-PARCセンター・中性子基盤セクションと連携して開発・製作を行う。本装置では、原子力機構・研究用原子炉JRR-3の生物用回折計(BIX-3, 4)に比べて、20倍以上の測定効率が期待される。
500mm)と楕円集光系については、J-PARCセンター・中性子基盤セクションと連携して開発・製作を行う。本装置では、原子力機構・研究用原子炉JRR-3の生物用回折計(BIX-3, 4)に比べて、20倍以上の測定効率が期待される。
樋口 真理子; Pinak, M.
no journal, ,
DNAの二本鎖切断はNHEJ(non-homologous end joining)過程によって修復される。ところが、鉄イオンの照射によって生じた二本鎖切断の修復は、X線照射によって生じたものよりも時間がかかることがわかっている。鉄イオンの方がDNA損傷を集中して発生させ、二本鎖切断に近接した他の損傷が修復を遅らせているのではないかと考えることができる。これを確かめるための第一歩として、NHEJ過程で最初にDNAと結合するKuと二本鎖切断近傍に酸化損傷を配置したDNAとの結合状態を分子動力学シミュレーションの手法を用いて調べた。その結果、酸化損傷が二本鎖切断の近傍にあると、Kuとの結合状態で構造揺らぎはやや大きくなった。しかし、DNAの構造エントロピーの結合による変化を調べると、両者には大きな差がないことがわかった。今後、DNAとKuの間の相互作用も調べる必要があるが、DNAの構造揺らぎの点ではKuと二本鎖切断の結合に関して酸化損傷の影響は小さいと考えられる。